当地时间6月13日,美国FDA发布了“器械软件功能上市前提交内容”的最新指南,该指南取代了2005年发布的版本,并更新了FDA推荐申办方在上市前提交用于对器械软件功能进行审查的文档,基于风险的方法的想法。
本指南中的建议旨在促进FDA的上市前审查。本指南描述了在软件开发、验证和验证期间通常会生成和记录的信息。根据FDA的经验,采用了最少负担的方法来确定通常需要的最低信息量,以支持使用软件器械的上市前提交。
申办方在上市前提交的文件中纳入FDA对软件功能器械的安全性和有效性的评估。这种想法认可了《21st Century Cures Act (Cures Act)》最近对《FD&C法》所做的修改,它修订了FD&C法案的第520条,并将某些软件功能排除在设备定义之外。它还考虑了数字健康的快速发展的本质,以及最近FDA认可的与软件相关的共识标准。
本指南不适用于评估上市后软件器械问题时可能需要的软件相关文档,包括更正和删除。
虽然本指南确定了申办方应在上市前提交中包含的文件,但本指南并不打算提供关于如何开发、验证和验证设备软件的建议。
本指南不建议使用任何特定的软件生命周期模型或开发方法。申办方应建立适合其产品和组织的软件生命周期模型,并满足适用的监管要求。所选的软件生命周期模型应涵盖软件的整个产品生命周期。
01/文档级别
Documentation Level
FDA打算采取基于风险的方法来帮助确定器械的文件级别,即Basic or Enhanced。文档级别的目的是帮助确定软件功能器械的上市前提交的最小信息量。
器械的文件级别是基于其器械软件功能在设备的预期用途中的风险,因此文件级别反映了整个设备。
为达到指南目的:
1.如果任何器械软件功能的故障或缺陷可能会对患者、设备用户或使用环境中的其他人造成可能导致死亡或严重伤害的危险情况,则应对于器械软件功能在内的任何上市前提交,提供Enhanced Documentation(增强文档)。
在实施风险管路之前,应对这些风险进行评估。申办方应考虑设备预期用途方面的风险(例如,对安全、治疗和/或诊断的影响),以及其他相关考虑因素。
2.对于不适用Enhanced Documentation(增强文档)的器械软件功能的上市前提交,应提供Basic Documentation(基本文档)。
在确定Documentation Level(文档级别)时,申办方应在实施风险管理之前考虑所有已知或可预见的软件危害和与设备相关的危险情况,包括那些由合理可预见的误用引起的,无论是有意的还是无意的。这也包括器械网络安全不足而有意或无意损害器械功能的可能性。
简而言之,就是要申办方风险评估中积极、全面地考虑风险。
虽然在本指南范围内的设备应单独评估,以确定适当的Documentation Level(文档级别),但对于某些类别的设备,FDA建议在上市前提交中提供Enhanced Documentation(增强文档)。
如以下器械:用于检测因输血传播感染而献血的器械、用于确定献血者和受血者相容性的器械、用于采集供输血或进一步生产使用的血液和血液成分的自动血细胞分离机器械,以及血液机构的计算机软件(BECS)。
除以上产品外,FDA认为,考虑到产品的性质及其预期用途,以下产品可能有独特的风险,需要进一步的文件,以确保FDA能够评估该器械的安全性和有效性。
包括组合器械(drug/device, biologic/device, drug/device/biologic)和III类器械。如果申办方评估Enhanced Documentation(增强文档)级别不适合自身产品,那申办方必须提供适当的理由,说明为什么Basic Documentation(基本文档)适合于上市前提交。在提交审查过程中,如果需要评估器械的安全性和有效性,FDA可能会要求提供额外的信息。当然申办方也可以通过预审核与FDA进行沟通。
02/推荐文档
Recommended Documentation
为方便申办方更好的了解FDA对于Enhanced Documentation和Basic Documentation不同的要求,FDA也通过表格的形式进行对照,方便大家参考了解。
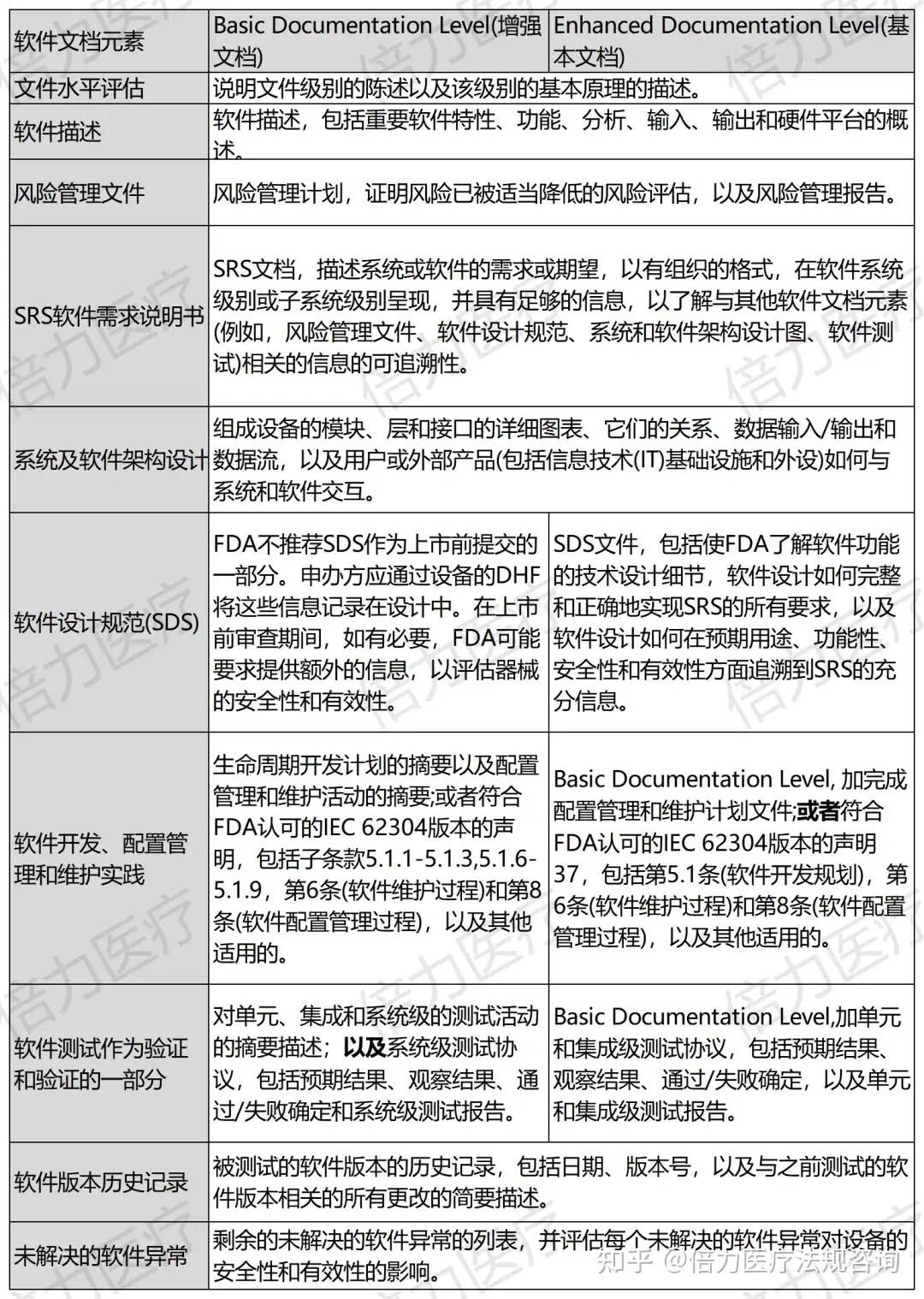
03/倍力总结
随着软件发展迭代更新,FDA继续更新自己的监管措施,以顺应时代的更迭。对于在2023年8月13日之前收到的提交文件的审查,通常CDRH工作人员不要求提供本指南中概述的新的建议信息。然而,如提交了任何该最终指南中的此类信息,CDRH会进行审核。近日FDA也将举办针对该最终指南的网络研讨会。
新闻资讯 News

电话:+86-137 1844 7675
地址:北京市房山区长阳怡和北路熙悦广场15-912室
天津市南开区南京路349号1003室 (新天地大厦)
邮箱:info@believe-med.com












